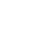邓宏魁团队连发两篇!干细胞领域再创新高
2025 年 5 月 8 日,美国《时代》(TIME)杂志公布了第二届年度 TIME100 Health 榜单,表彰全球健康领域最具影响力的 100 位个人。昌平实验室领衔科学家、北京大学博雅讲席教授邓宏魁荣登榜单。
(《时代》杂志原文链接:https://time.com/collections/time100-health-2025/7279669/hongkui-deng/)
2025 年 8 月 8 日,北京大学、北大-清华生命科学联合中心邓宏魁课题组在国际学术期刊 Cell Stem Cell 发表题为「Reconstruction of Endocrine Subtype-complete Human Pluripotent Stem Cell-derived Islets with Capacity for Hypoglycemia Protection in vivo」的最新研究成果(图 1)。该研究首次利用人多能干细胞成功分化构建了内分泌细胞类型完备的胰岛。这些胰岛能够高效响应血糖浓度变化,不仅能够有效降低血糖,更具备关键的升血糖功能,在糖尿病小鼠模型中展现出有效的低血糖防护能力,解决了干细胞来源的胰岛细胞类型及功能不全面的难题。

胰岛细胞具备调控血糖的能力,在糖尿病治疗方面具有巨大价值,是多能干细胞定向分化研究的焦点之一。邓宏魁团队经过二十余年系统研究,在这一领域取得了一系列突破。早在 2005 年,邓宏魁团队率先采用「体外分化模拟体内发育」策略,实现了小鼠多能干细胞向胰腺 β 细胞定向分化(Stem Cells, 2005);2007 年,团队报道了首个化学成分明确的人胚胎干细胞向胰岛细胞的定向分化方案(Cell Res., 2007);此后,团队进一步实现了诱导多能干细胞(iPS 细胞)向胰腺 β 细胞的定向分化(Cell Res., 2009);2022 年,团队在人多能干细胞制备方面取得重大突破,实现化学小分子诱导人多能干细胞(CiPS 细胞),为胰岛细胞分化提供了全新的种子细胞来源。
邓宏魁团队以人 CiPS 细胞为起点,在不同供体来源的人 CiPS 细胞系上实现了稳定、高效的胰岛细胞诱导,并在恒河猴糖尿病模型中验证了人 CiPS 细胞来源的胰岛细胞治疗糖尿病的安全性和有效性(Nat Med., 2022)。团队还创新性地建立了腹直肌前鞘下移植新策略,较传统移植方法创伤更小、操作简便、易于长期追踪观察,移植后胰岛存活和功能显著提升(Nat Metab., 2023)。
在充分开展临床前研究基础上,2023 年 6 月,天津市第一中心医院沈中阳、王树森研究组,北京大学、昌平实验室邓宏魁研究组,和杭州瑞普晨创科技有限公司合作,正式获批国家干细胞临床研究备案(备案号:MR-12-23-017130),开展了人 CiPS 细胞来源的胰岛细胞移植治疗 1 型糖尿病的 IIT 临床研究。首位患者在移植后恢复了内源自主性、生理性的血糖调控,移植 75 天后完全稳定地脱离胰岛素注射治疗,目前疗效已稳定持续 2 年以上,初步证明了基于化学重编程技术的胰岛细胞疗法安全有效(Cell, 2024)。
在干细胞来源的胰岛临床转化的关键阶段,研究团队进一步深入研究了保障安全性的策略。在胰岛功能方面,传统方案都聚焦于如何分化胰岛中分泌胰岛素的 β 细胞,具备降低血糖的功能。然而,天然胰岛是由 5 种内分泌细胞构成(β、α、δ、PP、ε 细胞),不仅包括 β 细胞,还包括了分泌胰高血糖素的 α 细胞以及分泌生长抑素的 δ 细胞等。多种内分泌细胞的构成不仅赋予了胰岛降低血糖的作用,还具备升高血糖的功能(血糖反向调节),从而构建血糖稳态。
临床数据显示,80% 的 1 型糖尿病患者存在低血糖症状,其中 20%-45% 会发生危及生命的严重低血糖,导致死亡率增加 3.4 倍。因此,低血糖防护对糖尿病患者至关重要,人多能干细胞分化的胰岛是否具备双向血糖调控及预防低血糖的能力,此前尚未充分研究。
本研究中,团队通过表观小分子调控乙酰转移酶(HAT)P300/CBP 活性,创新性地建立了非 β 内分泌细胞的高效诱导方案,结合重聚集技术成功构建了包含全部 5 种内分泌亚型的「重建胰岛」(图 2),通过调控重建胰岛中 5 种内分泌细胞的配比,解决了多能干细胞分化胰岛细胞类型缺失、胰岛功能不完善的问题。值得一提的是,β 细胞和非 β 细胞分别产生于独立的「胰岛芽」,再整合成功能性胰岛的策略,与人胰岛自然发育过程相似(J. Histochem. Cytochem., 2009; J. Clin. Endocrinol. Metab., 2012; Dev. Growth Differ., 2016),揭示了功能性内分泌细胞分化的规律。
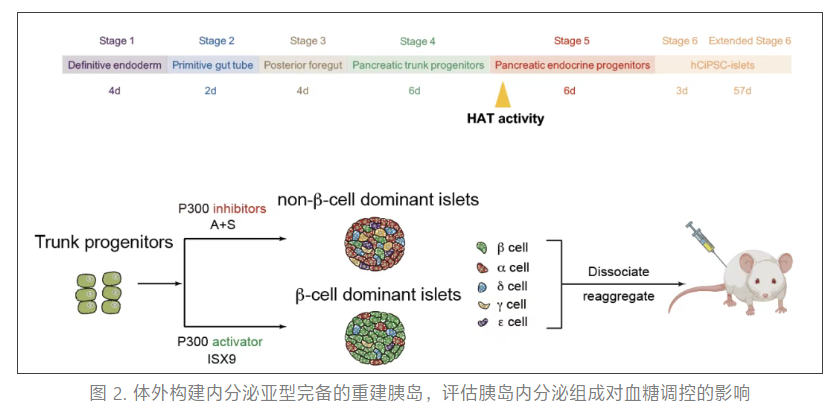
团队利用 1 型糖尿病小鼠模型验证了重建胰岛的功能,并取得三项重要发现:
1. 首次阐明胰岛细胞组成与血糖水平的定量关系,证实优化组成的重建胰岛更好维持生理性血糖水平;
2. 揭示非 β 细胞(特别是 α 和 δ 细胞)的低血糖防护功能,在胰岛素过量或禁食条件下能有效避免低血糖发生;
3. 通过高胰岛素-低血糖钳夹实验证实,重建胰岛可恢复机体的低血糖反向调节反应,包括更显著的 C 肽分泌「刹车」、胰高血糖素分泌激活和反向调节激素(如肾上腺素)的协同响应(图 3)。
该研究基于人多能干细胞建立了首个可精确调控 5 种内分泌细胞比例的胰岛制备体系,实现了通过工程化定制胰岛细胞组成,重现天然胰岛的双向血糖调控功能,为移植后实现精准血糖稳态调控、避免低血糖风险奠定了基础。这一进展为干细胞来源胰岛的临床转化提供了进一步的安全保障,有助于加速糖尿病细胞治疗的临床应用进程。
北京大学和杭州瑞普晨创孟高帆、顾佳斌、廖顺意和曹靖宵为该研究的共同第一作者。北京大学博雅讲席教授、昌平实验室领衔科学家、北大-清华生命科学联合中心邓宏魁教授,杭州瑞普晨创孟高帆博士是这一研究成果的共同通讯作者。南京医科大学第一附属医院周红文教授、付真真博士,北医三院王金琳博士,天津市第一中心医院王树森研究员,北京大学李程教授为本研究提供了重要帮助。本工作获得了北京市自然科学基金、浙江省「尖兵」「领雁」研发计划、国家重点研发计划和国家自然科学基金等支持。
免责声明:本文内容仅供读者学习和交流。文章、图片等版权归原作者享有,如有侵权,请留言联系。
-
超详细教程:论文图片要求有哪些,图片配色怎么调

超详细教程:论文图片要求有哪些,图片配色怎么调
-
SCI投稿:全流程详细指南

SCI投稿:全流程详细指南
-
一年中SCI黄金投稿期,终于被我拿捏了!

一年中SCI黄金投稿期,终于被我拿捏了!
-
干货 || 活细胞表面抗原的荧光染色(间接免疫荧光)

干货 || 活细胞表面抗原的荧光染色(间接免疫荧光)
-
南昌大学陈晔光院士团队发表Nature子刊论文

南昌大学陈晔光院士团队发表Nature子刊论文